Parte 1: Fotometria di massa
Nel panorama farmaceutico odierno, stiamo assistendo a una vera rivoluzione. I farmaci biologici di nuova generazione — dalle terapie a base di anticorpi complessi ai vettori virali (AAV) e alle nanoparticelle lipidiche (LNP) — stanno ridefinendo ciò che è possibile trattare e curare. Tuttavia, questa innovazione porta con sé una sfida monumentale: come possiamo analizzare e garantire la qualità di prodotti farmaceutici così sofisticati?
Le tecniche analitiche convenzionali, pur essendo state il pilastro dell’industria per decenni e mantenendo un ruolo fondamentale in molti processi di caratterizzazione, iniziano a mostrare i propri limiti in termini di risoluzione, contenuto informativo, velocità e complessità operativa.
Il gap analitico: perché i metodi tradizionali non sono più sufficienti
La produzione e caratterizzazione di farmaci biologici è intrinsecamente variabile. Ottimizzare i bioprocessi è un lavoro dispendioso in termini di tempo e risorse. I metodi classici spesso forniscono una visione “media” del campione, nascondendo l’eterogeneità molecolare e non risolvendo la complessità di strutture supramolecolari (HOS – High Order Structure) che possono fare la differenza tra un successo terapeutico e un fallimento qualitativo.
La svolta: tecniche a singola particella e fotometria di massa
Una delle innovazioni più interessanti è la Fotometria di massa. Questa tecnologia sviluppata da Refeyn sta colmando molti vuoti lasciati dalle tecniche convenzionali offrendo:
- velocità e semplicità: Risultati rapidi senza preparazioni complesse.
- risoluzione superiore: Capacità di visualizzare l’eterogeneità molecolare con una chiarezza senza precedenti.
- approfondimento diretto: Permette ai team di sviluppo di mantenere standard qualitativi elevati pur operando in tempi sempre più stretti con tempi di misura nell’ordine di pochi minuti.
Questo metodo rileva singole molecole in soluzione basandosi sulla luce che esse diffondono (scattering) quando interagiscono con una superficie di vetro. L’interferenza tra la luce diffusa e quella riflessa corrisponde alla massa della molecola. Ciò consente la misurazione diretta della massa con una risoluzione a singola particella senza l’uso di marcatori (label free), colonne o separazioni complesse. La tecnica richiede tipicamente solo 10-20 µL di campione a bassa concentrazione e fornisce risultati in un minuto, offrendo una rapida visione della composizione molecolare e dell’eterogeneità in condizioni quasi native.
Risolvendo le singole specie, la fotometria di massa implementata sullo strumento TwoMP è in grado di distinguere accuratamente le proteine intatte dagli aggregati, quantificare le proporzioni relative dei diversi stati oligomerici e identificare lievi variazioni nella qualità del campione che potrebbero sfuggire ai metodi di analisi massiva (bulk methods). Questo è particolarmente prezioso nei flussi di lavoro complessi degli anticorpi, dove l’aggregazione, la frammentazione e la stechiometria di legame influenzano le prestazioni e la sicurezza del prodotto.

Figura 1. La fotometria di massa (MP) consente di accelerare ulteriormente i tempi di realizzazione dei progetti eliminando le fasi di sviluppo del metodo (per ottimizzare colonne e tamponi) normalmente necessarie quando si passa da una modalità all’altra. MP è indipendente dalla modalità: caratterizza mAb, BsAb, ADC e altre modalità in pochi minuti utilizzando nanogrammi di campione. L’ampia compatibilità dei buffer e le misurazioni senza colonne richiedono solo una fase di ottimizzazione universal. L’unica operazione necessaria è diluire il campione sullo strumento. Tutti questi campioni (mAb, BsAb piccoli e grandi e un ADC) sono stati misurati su un TwoMP utilizzando la stessa metodologia.
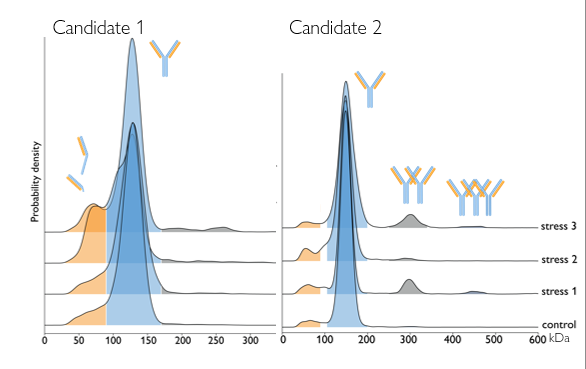
Figura 2. Studio di degradazione forzata. Disegno sperimentale ha previsto l’esposizione di 14 anticorpi a 3 fattori di stress (luce, pH, perossido). Misurazioni eseguite in triplicate (168 misurazioni in totale). Questo avrebbe richiesto 2 giorni di lavoro con il metodo SEC e microgrammi di campione per ogni misurazione. La fotometria di massa ha reso possibile tutto questo in mezza giornata, utilizzando solo 7,5 ng di campione per ogni misurazione.
La fotometria di massa viene inoltre sempre più adottata per l’analisi della purezza dei campioni di AAV (virus adeno-associati), in particolare per quantificare i capsidi vuoti, parzialmente pieni, pieni o eccessivamente pieni con risoluzione a singola particella con lo strumento dedicato SamuxMP.
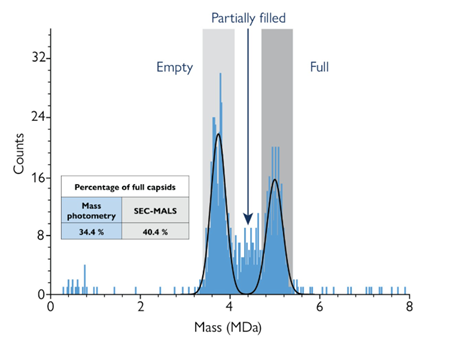
Figura 3 L’analisi di fotometria di massa dei capisidi AAV rivela popolazioni distinte di capisidi vuoti, parzialmente riempiti e riempiti in base alla massa delle singole particelle. La percentuale misurata di capisidi pieni (34,4%) è molto simile a quella rilevata con SEC-MALS (40,4%) con un notevole risparmio di tempo e campione.
Una tecnica strettamente correlata, la macro fotometria di massa implementata sullo strumento KaritroMP, estende questi principi a particelle virali più grandi. Per ogni particella, essa misura sia il contrasto (un indicatore della massa) che le dimensioni, consentendo una quantificazione precisa della purezza del campione e delle popolazioni vuote e piene, ad esempio, nei campioni di AdV (adenovirus).
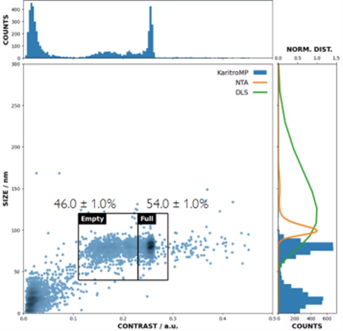
Figura 4 Le popolazioni piene e vuote sono state chiaramente risolte tramite l’analisi KaritroMP di una miscela contenente capisidi AdV vuoti, frammentati e pieni.
Insieme, questi approcci rapidi a singola particella offrono un modo per colmare il divario analitico per i moderni farmaci biologici, supportando processi decisionali più rapidi e informati in un’ampia gamma di modalità terapeutiche.
Oltre la Massa: Un Ecosistema di Innovazione
Non è solo la fotometria di massa a guidare il cambiamento. Molte altre tecnologie stanno trasformando la ricerca e sviluppo di prodotti farmaceutici sempre più innovativi. Nelle prossime edizioni di questa serie di newsletter parleremo di:
Parte 2: DLS + UV/VIS + Fluorescenza (Stunner): ortogonalità e sinergia per mettere in comunicazione tramite gli innovativi algoritmi UNMIX parametri apparentemente distanti tra loro e fornire una caratterizzazione completa di farmaci biologici, vettori virali e non virali con specifiche applicazione dedicate alla caratterizzazione di ADC, payload di LNP e AAV.
Parte 3: Microscopia a super-risoluzione: piattaforma di imaging che permette di visualizzare le interazioni farmaco-cellula a livello nanometrico, essenziale per lo studio delle nanoparticelle lipidiche (LNP) e dei biomarcatori.
Parte 4: SP-IRIS per lentivirus e EVs (Leprechaun): Una soluzione estremamente informativa per la caratterizzazione dei lentivirus e vescicole extracellulari.
Verso una R&D più chiara e veloce
Il messaggio è chiaro: per navigare in questa nuova era terapeutica, non è possibile affidarsi a strumenti del passato. L’adozione di analisi avanzate che offrono approfondimenti più veloci e chiari è l’unico modo per supportare la prossima generazione di terapie avanzate e portarle ai pazienti in modo sicuro ed efficiente. Ai prossimi appuntamenti.
Riferimenti:

